Mechanical Power
La genesi o il peggioramento del VILI rappresenta il risultato indesiderato di una complessa interazione tra forze meccaniche che agiscono sulle strutture polmonari, dipendendo certamente dalle impostazioni del ventilatore, ma anche dalle caratteristiche dell’apparato respiratorio e dall’interazione paziente-ventilatore. L’energia meccanica spesa dal ventilatore o dai muscoli respiratori per espandere i polmoni dalla capacità funzionale residua potrebbe indurre sia un danno diretto alla membrana capillare e alla matrice extracellulare alveolare, sia la meccano-trasduzione (ovvero la conversione di uno stimolo meccanico in segnali biochimici e molecolari intracellulari).
In tempi più recenti, quindi, l’attenzione si sta spostando da studi svolti a ricercare le singole variabili in grado di generare VILI, verso un’analisi più estesa che ingloba più fattori che i clinici quotidianamente gestiscono al letto del paziente come: volume, pressione, flusso inspiratorio e frequenza respiratoria. A partire da questa intuizione e visione, in letteratura sono state descritte diverse formule legate al concetto di mechanical power. Di seguito si tratta la versione formulata dal gruppo di lavoro di Gattinoni, che riteniamo essere la più completa durante ventilazione a volume-controllato (VCV). Prima di addentrarci nel complesso mondo del mechanical power è necessario riprendere alcuni parametri di ventilazione (già noti) che svolgono un ruolo cruciale nel danno polmonare: il volume corrente, la PEEP, la frequenza respiratoria e il flusso inspiratorio.
Il volume corrente
Ad oggi non esiste una ventilazione polmonare completamente sicura ed i principali effetti collaterali legati alla ventilazione meccanica sono il trauma meccanico alla struttura polmonare e l’instabilità emodinamica secondaria all’aumento delle pressioni intratoraciche. Tuttavia, da diversi anni, si è affermata la “ventilazione protettiva” che consiste in un approccio mirato ad una personalizzazione individuale del supporto ventilatorio, secondo il miglior compromesso tra meccanica respiratoria, reclutabilità, scambio gassoso ed emodinamica. Negli ultimi 30 anni si sono accumulate prove sperimentali che dimostrano che la ventilazione meccanica fornita con volumi e/o pressioni elevati possono danneggiare direttamente il polmone. Le attuali conoscenze suggeriscono che la ventilazione con volumi correnti elevati porta ad un processo di rottura alveolare. La rilevanza clinica del volume corrente è stata definitivamente dimostrata dai risultati dello studio ARMA, in cui un volume corrente più elevato era associato a una mortalità superiore di quasi il 10% rispetto al volume corrente più basso (12 vs 6 ml / kg su peso ideale). L’entità del coinvolgimento polmonare nei pazienti con ARDS è eterogenea e alcune aree dei polmoni sono più gravemente colpite di altre. Questa eterogeneità può determinare una quantità variabile di errata distribuzione del volume corrente erogato meccanicamente. Il risultato è che alcuni alveoli possono essere soggetti ad una maggiore distensione di altri; infatti, ci si aspetta generalmente di osservare un certo grado di iperinflazione delle regioni polmonari (relativamente) normalmente aerate. Inoltre, alcuni autori hanno ipotizzato con l’introduzione del concetto di “stress raisers” (amplificatori dello stress) che le disomogeneità del parenchima polmonare potrebbero aumentare localmente lo stress e la tensione. Per meglio chiarire il concetto, è stato ipotizzato che la ventilazione di alveoli sani situati vicino a unità polmonari non aerate e/o anormali può generare forze di taglio elevate che generano o amplificano la lesione del tessuto polmonare, anche se la pressione applicata era entro limiti di sicurezza. I pazienti con ARDS ventilati con un volume corrente basso, in base alla strategia di ventilazione polmonare protettiva, possono ancora essere esposti a forze che possono indurre lesioni o peggiorare la funzione polmonare; infatti, come accennato in precedenza, lo sforzo applicato dipende dalle dimensioni del baby-lung. Diversi autori hanno proposto una strategia di ventilazione ultra-protettiva basata su un’ulteriore riduzione del volume corrente da 6 a 4 ml / kg e della pressione di plateau da 30 a 25 cmH2O. Questa impostazione potrebbe ridurre al minimo l’iperinflazione e attenuare l’infiammazione polmonare. Tuttavia, la ventilazione meccanica con volume corrente ultra-basso e pressione di plateau inferiore non esclude che alcune regioni polmonari siano comunque soggette a fenomeni atelettasici.
Frequenza respiratoria e flusso inspiratorio
In tempi molto recenti i ricercatori hanno rivolto l’attenzione verso gli effetti della frequenza respiratoria in tema di VILI, partendo dal presupposto che se un dato volume corrente è pericoloso ad una frequenza di 10 bpm, ci si potrebbe aspettare che sia più pericoloso a 25 bpm. Anche questo elemento potrebbe presentare una chiara analogia con la resistenza fisica dei materiali, che a lungo andare cedono sotto i “colpi” di eventi stressanti. In uno studio, animali da esperimento sono stati sottoposti ad uno strain maggiore di 2. Le cavie sottoposte a questa elevata deformazione polmonare e con una frequenza respiratoria di 15 bpm morivano, mentre quelle sottoposte ad una frequenza di 3 o 6 bpm non presentavano alcun effetto dannoso. Anche l’impostazione di un flusso inspiratorio elevato potrebbe giocare un ruolo nella generazione del VILI. In un recente studio sperimentale due gruppi di animali sono stati ventilati per 54 h, con una frequenza respiratoria di 15 bpm e con il medesimo strain. L’unica differenza nel trattamento risiedeva nel rapporto I:E. Dalle conclusioni è emerso che gli animali con un rapporto I:E di 1:2-1:3 sviluppavano edema polmonare nel 20% dei casi, mentre nel gruppo con elevato flusso inspiratorio (fino a ratio di 1:9) ben il 73%. Gli autori ipotizzano che un’elevata velocità del flusso possa aggravare in modo consistente il polmone durante ARDS, essendo il parenchima patologicamente disomogeneo e quindi incapace di dissipare (ed in poco tempo) le forze che su di esso agiscono.
PEEP
Il razionale legato all’utilizzo della PEEP è volto al recupero di aree con perdita di compliance polmonare. L’impostazione al ventilatore di una PEEP potrebbe: rendere più omogeneo il polmone attraverso il reclutamento alveolare, prevenire il collasso alveolare e ridurre gli effetti deleteri legati alla ciclica chiusura ed apertura di unità alveolari. L’impostazione della PEEP nei pazienti con ARDS è tradizionalmente accettata dalla comunità scientifica come una importante risorsa protettiva dal VILI. La dicotomica impostazione di una PEEP alta contrapposta ad una bassa non ha prodotto un chiaro ed inequivocabile “vincitore”. Tra i diversi motivi che possono spiegare questa mancanza di chiarezza spicca senz’altro la più o meno marcata disomogeneità del polmone durante ARDS ed i possibili ed altrettanto diversi effetti della PEEP. Infatti, ciascuna compliance regionale del polmone potrà rispondere all’apposizione di una PEEP esterna in tre modi:
- aumento della compliance totale per reclutamento di unità alveolari che precedentemente non partecipavano alla ventilazione;
- nessun cambiamento della compliance con modifica del solo volume alveolare;
- diminuzione della compliance correlata a sovradistensione.
La coesistenza di più variabili legate alle caratteristiche delle regioni polmonari e l’altrettanta eterogenea risposta alla PEEP determinerà un risultato finale che mostrerà l’effetto predominante. Dalla letteratura sembra emergere che l’utilizzo di PEEP elevate sia particolarmente deleterio nei pazienti con ARDS focale, producendo un quadro di iperinflazione delle zone sane ed un minimo effetto di reclutamento nelle aree basali soggette ad infiltrati alveolari. Ad esse, poi si associano imprevedibili risposte del sistema cardiovascolare. Nelle ARDS pare essere in generale, quindi, più temibile la sovradistensione indotta da elevata PEEP piuttosto che la genesi di atelectrauma, che potrebbe svilupparsi in presenza di bassa PEEP. I diversi trial hanno rafforzato l’idea che il miglior modo di impostare la PEEP risieda nella sua individualizzazione attraverso la valutazione della meccanica respiratoria, degli effetti emodinamici e della posizione del paziente (supino vs prono). Per valutare se la PEEP impostata migliora la compliance, è necessario eseguire misure di meccanica respiratoria attraverso l’esecuzione di un PEEP trial.
Calcolo del Mechanical Power in VCV
L’equazione di moto dell’apparato respiratorio quantifica le diverse pressioni presenti nel sistema respiratorio in un dato momento: PEEP totale, pressione elastica e pressione resistiva. L’equazione di moto dimostra che in ogni punto del ciclo respiratorio la pressione nelle vie aeree è data dalla somma di PEEP totale, Pressione elastica (la pressione generata dal volume corrente introdotto nell’apparato respiratorio) e Pressione resistiva (la pressione necessaria a generare il flusso e introdurre aria nelle vie aeree).
PAW = P0+ Pel + Pres (1) PAW = (PEEPe + PEEPi) + E x VT +R x flow (2)
Se si moltiplicano per ciascuna pressione dell’equazione di moto (P0, DP e Pres) le variazioni di volume corrente, si ottiene la seguente formula che esprime l’energia fornita dal ventilatore all’apparato respiratorio per ciascun ciclo inspiratorio:
Energia= ΔV x PEEP + ΔV x (E x ΔV) + ΔV x (R x Flow) (3)
Sostituendo il flusso con ΔV/tempo inspiratorio (Ti) si ottiene:
Energia= ΔV x PEEP + ΔV x (E x ΔV) +ΔV x (R x ΔV/Ti) (4)
Energia= ΔV x PEEP + ΔV x (E x ΔV x 1/2) + ΔV x (R x ΔV/Ti) (5)
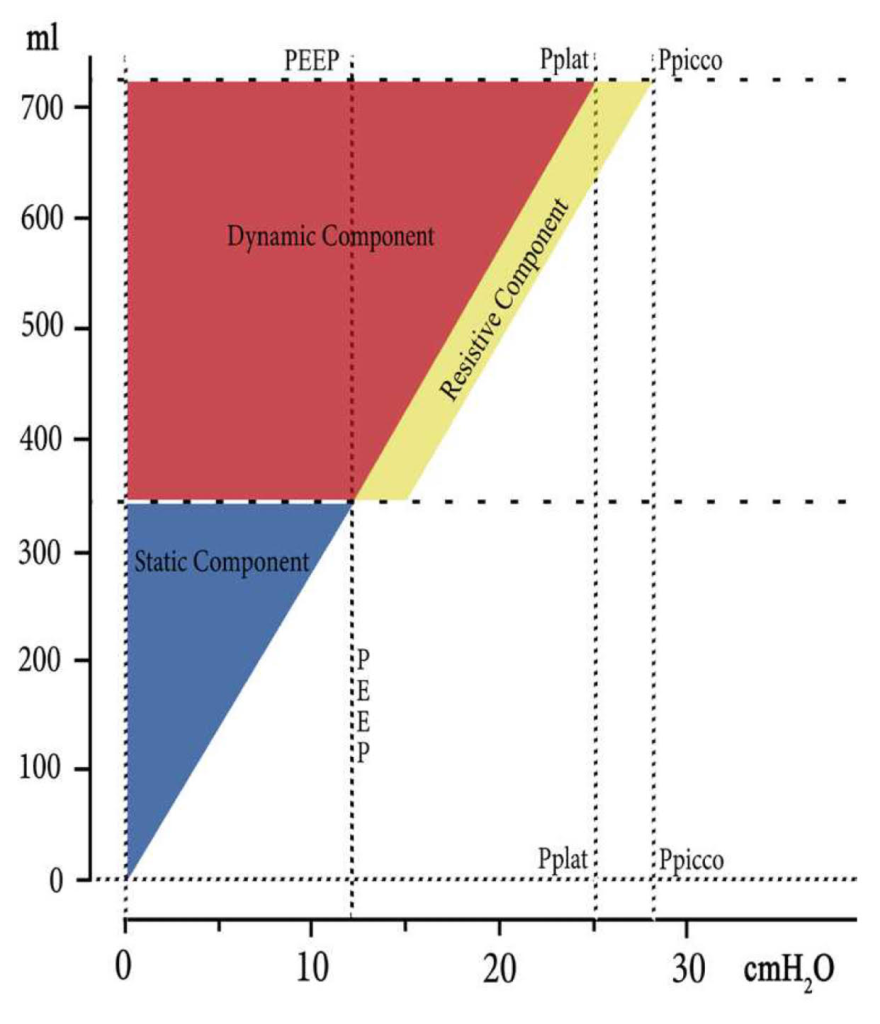
Perché E x ΔV x 1/2? Per comprendere questo passaggio è necessario analizzare la figura 1. Gli autori suddividono le componenti dell’energia applicata attraverso le aree geometriche derivate. In azzurro è mostrato un triangolo che si costruisce a partire dalla prima applicazione della PEEP (nell’esempio specifico la progressione da ZEEP verso 12 cmH2O), cui segue un’area rettangolare (in rosso) conseguente al mantenimento della PEEP a tale valore ed al volume generato da essa. Al di sopra di essa si sviluppa, invece, un’area triangolare (base x altezza/2) che rappresenta l’energia applicata con l’introduzione del volume corrente e derivata dal prodotto tra ΔV e driving pressure (E x ΔV). Per questo motivo si effettua la correzione, approssimando l’integrale del prodotto, espressa nell’equazione 5.
Dopo semplificazione dell’equazione 5 si ottiene:
Energia = ΔV x PEEP + ΔV2 x (E x 1/2 + R x 1/Ti) (6)
La formula prevede, poi, il calcolo del tempo inspiratorio (Ti) in relazione alla frequenza respiratoria (Fr) ed al rapporto I : E
Ti = 60/Fr x (I:E/(1+I:E) (7)
Sostituendo tale rapporto all’interno dell’equazione ne deriva che:
Energia = ΔV x PEEP + ΔV2 x [E x 1/2 + R x Fr x ((1+ I:E)/60 x I:E)] (8)
Infine, moltiplicando l’energia applicata all’apparato respiratorio in fase inspiratoria per la frequenza respiratoria si ottiene l’equazione della potenza meccanica:
Mechanical power = 0,098 x Fr x {ΔV x PEEP + ΔV2 x [E x 1/2 + R x Fr x ((1+ I:E)/60 x I:E)]} (9)
In cui, a riassunto conclusivo:
• 0,098 è il fattore di conversione da Litri × cmH2O a Joule;
• Fr è la frequenza respiratoria;
• E è l’elastanza dell’apparato respiratorio;
• I:E è il rapporto tra il tempo inspiratorio ed espiratorio;
• R è la resistenza delle vie aeree;
• ∆V è il volume corrente.
Esempio 1 Paziente sano che ventila in VCV:
• Frequenza respiratoria di 10 bpm;
• Volume corrente di 0,4 L;
• Rapporto I : E di 1:2;
• Elastanza apparato respiratorio di 10 cmH2O/L;
• Resistenza di 5 cmH2O/L/s;
• PEEP 5 cmH2O.
La potenza meccanica espressa in Joule/minuto è 3,136:
0.098 x 10 x {0,4 x 5 + 0,42 x [10 x 1/2 + 5 x 10 x ((1+ 1:2)/60 x 1 : 2)]}
Esempio 2. Paziente con ARDS in VCV:
• Frequenza respiratoria di 24 bpm;
• Volume corrente di 0,38 L;
• Rapporto I : E di 1:1;
• Elastanza apparato respiratorio di 35 cmH2O/L;
• Resistenza 10 cmH2O/L/s;
• PEEP 12 cmH2O.
La potenza meccanica è 19,12 Joule/min:
0,098 x 24 x {0,38 x 12 + 0,382 x [35 x 1/2 + 10 x 24 x ((1+ 1:1)/60 x 1:1)]}
In considerazione della già complessa formula, si propone di utilizzare l’equazione di energia (6), a cui si aggiunge la conversione in Joule e la frequenza respiratoria, come mostrato nel punto (9). Questo a nostro avviso semplifica il calcolo perché il tempo inspiratorio non è presentato in funzione della frequenza respiratoria e del rapporto I:E. In realtà tale valore è facilmente deducibile dal ventilatore.
Potenza = 0,098 x Fr x {ΔV x PEEP + ΔV2 x [E x 1/2 + R x 1/Ti]}
Questa equazione, seppur risulti essere la più accurata per misurare la potenza meccanica di un paziente che ventila passivamente in VCV, è ancora poco utilizzata. Per i clinici non è certamente semplice da comprendere ed i parametri come le resistenze e l’elastanza del sistema respiratorio, non sono facilmente misurabili. A tal proposito gli stessi autori propongono una versione più semplice e snella:
Potenza = 0,098 x Fr x ΔV x [Ppicco – ((Pplat – PEEP)/2)]
La ricerca in tema di ARDS e VILI è un mosaico estremamente complesso da cui scaturisce la difficoltà nell’identificazione di “numeri magici” che potrebbero facilitare i clinici nel lavoro quotidiano. La mancanza di certezze in diverse aree è imputabile ai molteplici meccanismi patologici sottostanti alla genesi del VILI, alle caratteristiche intrinseche delle lesioni polmonari che possono essere focali/regionali/estese o una combinazione tra esse; allo stadio ed alla gravità del quadro patologico (se in fase remissiva o evolutiva); agli effetti della ventilazione meccanica e la ricerca di soglie protettive utili a non generare un danno diretto o ad aggravare una lesione preesistente. Gli studi condotti su animali, basati sulle caratteristiche della TC del polmone, hanno evidenziato che una potenza meccanica superiore a 12 J/min potrebbe generare VILI, indipendentemente dalle diverse combinazioni di ciascun componente. Questo dato suggerisce che la valutazione della potenza meccanica dovrebbe essere superiore rispetto l’analisi dei singoli componenti che si impostano al ventilatore. Uno studio osservazionale condotto su umani non ha trovato alcuna relazione causale tra la potenza meccanica e la mortalità. Da altri studi, contrariamente, emerge:
- un’associazione con mortalità più elevata nei pazienti in condizioni critiche e con potenza meccanica > 17 J/min;
- una potenza meccanica > 22 J/min è associata ad un aumento della mortalità a 3 anni e a 28 giorni nei pazienti con ARDS;
- una potenza meccanica > 25 J/min ha causato un danno polmonare più significativo e potenzialmente letale rispetto a valori inferiori;
- nei pazienti trattati con ECMO, una potenza meccanica > 14,4 J/min durante i primi 3 giorni era l’unica variabile ventilatoria indipendentemente associata alla mortalità ospedaliera a 90 giorni.
Tuttavia, il vantaggio di calcolare la potenza meccanica non è chiaro e il suo uso clinico è limitato dalla complessità della sua misurazione e dell’interpretazione. Un altro nuovo parametro interessante è la formula di Costa et al. (4 × ∆P) + RR, che ha mostrato un’associazione significativa con la mortalità (HR = 1.152, 95% IC = 1.040–1.276, p = 0.006) e scarso esito neurologico (OR = 1.244, IC 95% = 1,015–1,525, p= 0,036) con una performance migliore rispetto alla potenza meccanica nei pazienti dopo arresto cardiaco senza ARDS. Nonostante i suoi potenziali vantaggi, questa formula è stata testata solo come associazione osservativa con il risultato e necessita di ulteriori indagini. Questa formula è stata recentemente studiata in pazienti senza ARDS post-arresto cardiaco. Nell’analisi di Robba et al, la formula calcolata come (4 × ΔP) + RR era indipendentemente associata a mortalità e scarso esito neurologico. Gli autori hanno rilevato che dopo l’arresto cardiaco, le impostazioni del ventilatore (in particolare ∆P e RR) nei primi 3 giorni dopo il ricovero in ospedale influenzano gli esiti del paziente a 6 mesi.
Fonte :