Legge di Dalton o delle Proporzioni Multiple
Fonte :
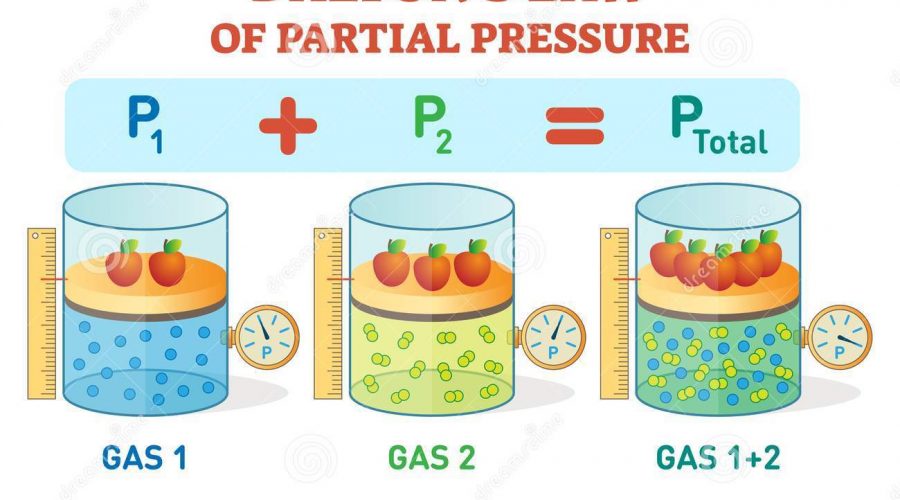
LA LEGGE DELLE PROPORZIONI MULTIPLE, CHIAMATA ANCHE LEGGE DI DALTON, È LA CONCLUSIONE DELLE 3 LEGGI FONDAMENTALI DELLA CHIMICA, QUESTA INTUIZIONE PERMISE A JOHN DALTON DI DIMOSTRARE IN MODO ANCORA PIÙ SOLIDO LA LEGGE DI PROUST E MISE LE BASI PER LA PRIMA TEORIA ATOMICA DELLA CHIMICA MODERNA.
Come spesso abbiamo detto la Natura non si lascia descrivere facilmente, se un giorno scopriamo qualcosa di nuovo quel nuovo non è che un frammento di un concetto più grande. In questo caso tra la Legge di Proust e la Legge di Dalton passano pochi anni, meno di 20 per vedere l’espansione delle idee di Proust.
Anche se la Legge delle proporzioni definite, che è un alto modo per chiamare la Legge di Proust, era stata accettata dalla maggior parte degli scienziati dell’epoca restavano ancora alcune domande. Si sapeva per esempio che facendo reagire lo Stagno (Sn) con l’Ossigeno (O2) si potevano ottenere 2 composti diversi, ossido stannico (SnO2) e ossido stannoso (SnO). Ovviamente alla fine del 1700 non sapevano scrivere i composti usando le formule come facciamo noi oggigiorno ma potevano determinare le masse dei vari reagenti.
Sapevano che “bruciando” lo Stagno in polvere con l’Ossigeno si otteneva un prodotto con una massa superiore, e fino a questo ragionamento erano arrivati anni prima. Quello che si scopri fu che facendo reagire la polvere di Stagno con l’Ossigeno in condizioni diverse si ottenevano 2 prodotti di massa diversa.
In un caso se la polvere la si bruciava all’aria aperta si otteneva il prodotto più pesante cioè SnO2, nel caso in cui lo si facesse reagire con una quantità ristretta di Ossigeno si formava un composto avente massa diversa. Che avesse dunque ragione Berthollet nell’affermare che le condizione operative fanno variare il rapporti di massa? No, perchè i prodotti che si ottenevano non erano lo stesso composto, avevano proprietà chimiche e fisiche diverse, seguivano quindi 2 reazioni diverse. La legge di Proust era salva, restava da capire il perchè di questo fenomeno.

Proust nei suoi esperimenti aveva trattato gli ossidi di stagno e aveva certamente notato questa discrepanza ma non riusciti a spiegare il perchè lo Stagno si comportava in questo modo. Se però si assumeva che lo Stagno dava 2 reazioni diverse, perchè i prodotti che si ottenevano erano diversi, la Legge di Proust era comunque valida. Questi 2 particolari elementi, Stagno e Ossigeno, potevano reagire soltanto secondo 2 rapporti di massa precisi, non erano ammesse tutte le combinazione possibili di massa tra i reagenti perchè se così fosse si sarebbero ottenuti prodotti impuri, contaminati quindi con il reattivo in eccesso.
[safe_file_download id=39]