Gestione dei flussi con i moderni ventilatori per anestesia
Chi lavora in area critica sa bene che vi sono diverse “macchine” che consentono l’erogazione della ventilazione meccanica. Vi è oggi un’ampia gamma di ventilatori e ciascuno con specifiche tali da poter essere utilizzati con sicurezza in tutti i contesti ospedalieri e non, a partire dai sofisticati ventilatori da terapia intensiva fino a quelli utilizzati per la ventilazione a domicilio del paziente. Questo post tratterà il ventilatore di anestesia e nello specifico la gestione dei flussi, presidio che soprattutto negli ultimi anni ha subito notevoli innovazioni tecnologiche. Per fare questo, mi sono avvalso del prezioso aiuto di un amico ed esperto del settore, l’ing. Moustapha Ntieche.
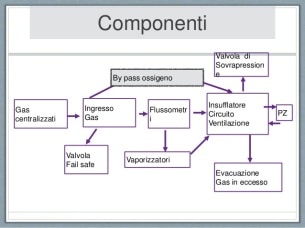
Un ventilatore per anestesia è composto da diverse parti, che collegati tra loro formano un sistema integrato che permette la ventilazione polmonare, la somministrazione di agenti anestetici e il monitoraggio di queste funzioni. Le parti principali sono la sorgente dei gas, il ventilatore, il vaporizzatore degli anestetici, il circuito di ventilazione, la calce sodata, l’apparato per l’evacuazione dei gas e gli strumenti per il monitoraggio. Nell’immagine 1 si mostra uno schema esemplificativo del percorso dei flussi attraverso le componenti di un ventilatore di anestesia¹. Nella figura 2 e 3 sono raffigurati due diversi sistemi rotatori, uno con funzionamento a cilindro-pistone e l’altro a turbina¹.
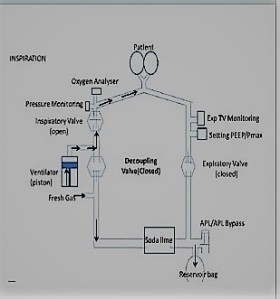
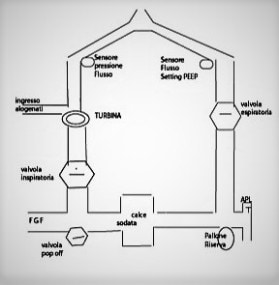
La gestione dei flussi in un circuito d’anestesia rotatorio
I flussi di ossigeno, aria e/o protossido di azoto provengono dall’impianto centralizzato con una pressione elevata. I flussimetri che sono posti tra i gas centralizzati ed il paziente svolgono il duplice ruolo di:
- riduzione, attraverso delle valvole, della pressione dei flussi ad un livello simile alla pressione atmosferica;
- gestione del flusso da erogare al paziente.
In letteratura vi sono diverse classificazioni che discriminano la quantità del flusso somministrata al paziente. Una di queste è una classificazione che ha come unico parametro di riferimento il flusso di gas freschi (FGF) erogato in relazione alla ventilazione/minuto (VM) del paziente, e distingue:
- Sistemi semiaperti se il FGF è uguale o maggiore del VM del paziente (non vi è re-inalazione della miscela espirata)
- Sistemi semichiusi se il FGF è inferiore al VM del paziente (con reinalazione parziale dei gas espirati)
- Sistemi chiusi se il FGF è talmente basso da essere pari al Tidal Volume del paziente (con il 100% di re-inalazione dei gas espirati)3.
Un’altra classificazione si riferisce alla quantità di FGF definito come “multiplo del Consumo di O2 (VO2) del paziente” calcolato in base all’ equazione di Brody2:
VO2 = 10 x BW (Kg) x 0,75 ml/min/m² (dove 0.75 è un coefficente fisso per l’impedenza offerta dal circuito e per i soggetti di peso compreso fra 30 e 120 Kg) ,
da qui si distinguono:
- Sistema chiuso se il FGF = 10 – 20 ml x Kg x 0,75 ml · min-1. Re-inalazione di tutto il volume minuto espirato previo passaggio dal canestro di calce sodata dove viene privato della CO2.
- Sistema a basso flusso (o semichiuso) se il FGF = 25 – 50 ml x Kg x 0,75 ml · min-1. Re-inalazione parziale, in percentuali variabili dal 20 al 50%, dei gas espirati. L’uso dei bassi flussi prevede l’impiego di FGF che consenta almeno il 50% di re-inalazione, il che comporta un FGF < 2 lt min-1
- Sistemi a flussi intermedi se il FGF = 50 – 150ml x Kg x 0.75 ml · min -1
- Sistemi ad alti flussi se il FGF > = 150ml x Kg x 0.75 ml/min (senza reinalazione e dunque corrispondenti ai tradizionali sistemi aperti)3.
Questa classificazione è basata sul concetto di VO2 come presupposto essenziale per definire “chiuso, semichiuso, aperto” un circuito di anestesia e identifica il FGF col consumo di O2 partendo dal presupposto che il FGF dentro un circuito di anestesia, deve sempre essere superiore al consumo metabolico basale di O2 del paziente che vi è collegato3.
In passato i pericoli maggiori derivavano dall’impossibilità di misurare la quantità di ossigeno inspirato e la concentrazione di gas anestetico, con il rischio di indurre ipossia e/o inadeguato livello di concentrazione del gas anestetico. Per questo motivo il circuito chiuso era considerato una tecnica pericolosa e non ottenne un grande consenso4.
Vi è un’altra classificazione molto più semplice suggerita da Baxter5 e oggi generalmente accettata che definisce:
- Flusso alto > 4 l · min -1
- Flusso medio 1-2 l · min -1
- Flusso basso 500-1000 ml · min -1
- Flusso minimo 250-500 ml · min -1
- Flusso metabolico < 250 ml · min -1
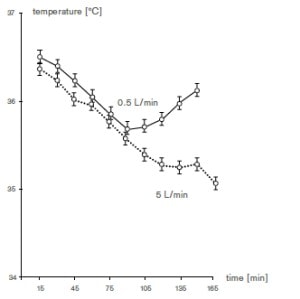
I benefici e la fattibilità dei bassi flussi in anestesia sono stati proposti negli ultimi trentanni6. Nel 1995 Baum e Atikenhead presentarono il seguente sommario: “sebbene vi siano potenziali rischi associati all’utilizzo di bassi flussi, i ventilatori moderni soddisfano i requisiti per un uso sicuro della tecnica a basso flusso se associato ad un monitoraggio delle concentrazioni di gas inspiratorio ed espiratorio. I benefici includono il risparmio di agenti inalanti, mantenimento della temperatura corporea e umidificazione delle vie aeree, riduzione dell’inquinamento ambientale. Gli svantaggi includono un potenziale e teorico rischio ipossico, un’inadeguata concentrazione di gas anestetico”7.
Come cambiano le impostazioni in un sistema ad alto e basso flusso?
In un paziente sottoposto a ventilazione meccanica durante anestesia generale è stato impostato un volume corrente di 500 ml con una frequenza respiratoria di 12 atti · min -1.
Il volume minuto (VM) corrisponderà a 500 x 12 = 6 l·min-1. Se si lavora con un alto flusso di gas freschi, per esempio 8 l · min -1, il circuito si definisce aperto in quanto tutto il volume espirato viene eliminato e durante l’inspirazione verranno dati gas freschi. Con questo sistema (aperto) non vi è re-inalazione della miscela gassosa espirata ed il paziente riceve ad ogni minuto gas freddi e secchi, con un alto consumo di alogenato e maggiore inquinamento.
Se in alternativa si decide di ridurre il flusso di gas freschi a 1 l·min-1, mantenendo le impostazioni precedenti (VM 6 l·min-1), il volume espirato (dopo essere stato “lavato” dalla CO2 grazie alla calce sodata) sarà riutilizzato per una nuova insufflazione. Il ventilatore ogni minuto farà ricircolare nel circuito 5 l di volume espirato, e introdurrà 1 l di gas fresco in modo da assolvere al compito di garantire livelli adeguati di O2 e di agente anestetico nella miscela inspiratoria. Il ricircolo continuo permette il risparmio del vapor anestetico, il riscaldamento e l’umidificazione delle vie aeree.
Flussi minimi e anestesia quantitativa
In letteratura si parla di bassi flussi quando il flusso totale dei gas freschi (FGF) è ≤ 1l/min e di flussi minimi quando quest’ultimo è inferiore o uguale a 0,5 l/min. Con qualche sistema si parla addirittura di anestesia quantitativa o metabolica. In quest’ultimo caso il consumo di alogenato e di O2 corrispondono al consumo metabolico del paziente. Di fatto è un sistema che non viene routinariamente utilizzato nella pratica clinica perché si lavorerebbe ai limiti della sicurezza del paziente senza trarre vantaggi maggiori rispetto all’impiego dei sistemi a bassi flussi3. Il sistema di gestione dell’anestesia metabolica deve avere l’iniezione dell’anestetico alogenato e l’erogazione di O2 completamente svincolati dal FGF.
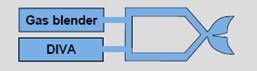
L’obiettivo primario del Flusso di gas freschi (FGF) è quello di garantire il fabbisogno metabolico di O2 del paziente e compensare le perdite dell’intero sistema. Di conseguenza, più il sistema è a tenuta più è ampio il margine per abbassare il FGF. Per fare questo, dobbiamo chiarire la funzione del miscelatore elettronico (fig.5) che è presente su tutti gli apparecchi per anestesia di fascia medio-alta.


Il miscelatore elettronico (fig.5) rispetto alla vecchia scatola flussometrica (fig.7) ha il vantaggio di essere molto preciso e di avere dei sistemi di sicurezza per garantire una concentrazione di O2 di almeno 25% e la somministrazione di almeno 150 ml·min-1 di ossigeno.
A questo punto è opportuno chiarire un concetto che potrebbe sfuggire agli utilizzatori che vengono dall’esperienza dei sistemi con la scatola flussometrica.
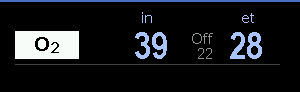
Nella figura 5 la sigla FG O2 non rappresenta la FiO2 (frazione inspiratoria di ossigeno), bensì la percentuale di O2 nel flusso totale o flusso dei gas freschi (FGF) che in questo caso è di 1 l·min-1. La FiO2 effettivamente erogata al paziente in inspirato è di 39% (fig.6) e viene misurata tramite l’analizzatore dei gas integrato nell’apparecchio di anestesia.
Questa differenza tra FG O2 54 e FiO2 39 è correlata all’effetto della diluizione tra il flusso di gas freschi (1 l·min-1) e la quota di espirato (povera di O2) proveniente dal paziente e reintrodotta nel sistema respiratorio. Tanto più sarà chiuso il circuito tanto più sarà alto l’effetto della diluizione.
La gestione dei bassi flussi richiede una maggiore attenzione rispetto ad un circuito aperto o semi aperto. A questo punto torna utile l’allarme sulla FiO2 minima. Qualche sistema è dotato di un sistema di previsione dei successivi 20 minuti della FiO2 tenendo conto del consumo di O2 del paziente e delle perdite del sistema.
Correlazione FGF e vaporizzatori
Possiamo mostrare schematicamente la correlazione del FGF e vaporizzatori negli apparecchi di anestesia nelle immagini sottostanti:

La figura 8 rappresenta la struttura più comune degli apparecchi per anestesia dove abbiamo il FGF e il vaporizzatore in serie. Si evince da questa figura che il trasporto di alogenato verso il circuito interno e il paziente è totalmente dipendente dal FGF che si comporta da gas carrier o di trasporto. Questa è la ragione per la quale lavorando a bassi flussi (≤1l/min) bisognerebbe aprire adeguatamente il vaporizzatore per soddisfare l’obiettivo in termine di concentrazione inspiratoria di alogenato al paziente. Con questo tipo di architettura, si può comunque effettuare un’anestesia a bassi flussi ma le varie performance o limitazioni sono più legate alla pneumatica del ventilatore (pistone, concertina, turbina…). La figura 9 è quella di un sistema in parallelo dove l’erogazione di alogenato è controllata da un dispositivo elettronico con una iniezione completamente elettronica indipendente dal FGF. Questo è il motivo per il quale questo tipo di dispositivo può effettuare un dosaggio sia di alogenato sia di O2 di tipo metabolico puro o anestesia quantitativa. Da sottolineare che il controllo automatico dell’EtAA (End tidal dell’agente anestetico) e della FiO2 viene effettuato anche dai sistemi con architettura in serie, quindi senza iniezione diretta dell’agente anestetico, ma regolando il Flusso di gas freschi.
Un altro elemento non da poco nella gestione dei bassi flussi è la costante di tempo del sistema respiratorio. Questa costante di tempo è proporzionale al volume interno del sistema respiratorio o spazio morto del sistema. In altre parole, più è ampio il volume interno al ventilatore, più tempo impiega il sistema ad arricchirsi di alogenato nella fase di wash-in (induzione dell’anestesia) e di conseguenza con una fase di wash-out (risveglio) più lunga.
Cosa monitorare con attenzione durante anestesia a basso flusso?
- La concentrazione inspiratoria di ossigeno;
- La pressione all’interno delle vie aeree e/o il volume minuto;
- La concentrazione dell’agente anestetico nel circuito;
- L’assenza di FiCO2 (frazione inspiratoria di anidride carbonica)8.
Fonte :